
Larutan Elektrolit dan Non Elektrolit
Berikut adalah manfaat larutan non elektrolit. 1. Sebagai sumber energi. Gula adalah salah satu komponen larutan non elektrolit. Gula ini merupakan sumber energi dalam bentuk karbohidrat sederhana. Ketika tubuh manusia kekurangan gula, maka akan terasa lelah, jantung berdebar, dan sulit berkonsentrasi.

Larutan Elektrolit dan Non Elektrolit
Sobat Pijar, itulah wawasan tentang larutan elektrolit dan larutan non elektrolit. Semoga penjelasan tadi dapat membantumu memahami perbedaan keduanya dan memberikan gambaran lebih jelas tentang sifat-sifat unik yang dimiliki oleh masing-masing jenis larutan, ya! Gimana, semakin tertarik belajar Larutan Elektrolit dan Non Elektrolit lebih lanjut?
Mengidentifikasi Ciri Ciri Dan Perbedaan Larutan Elektrolit Dan Non Riset
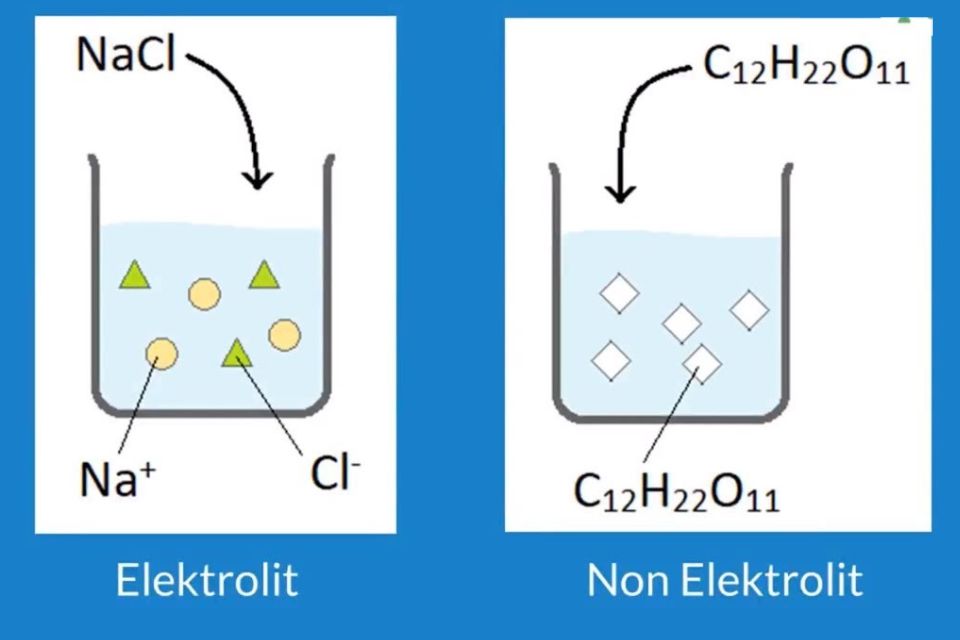
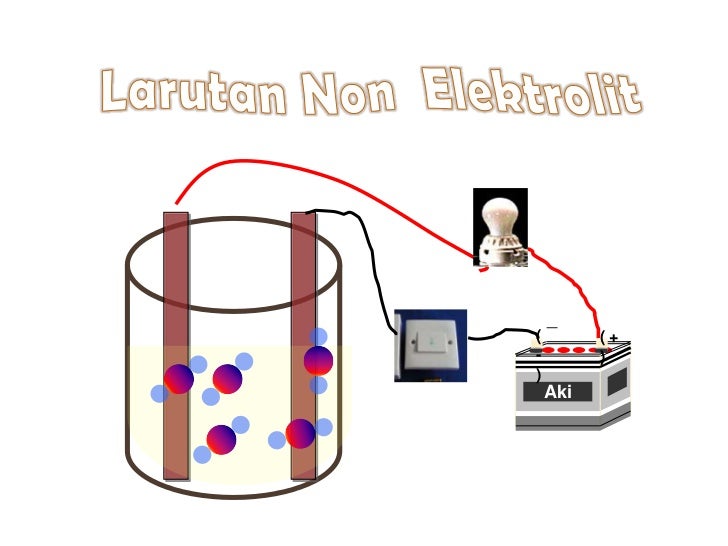
Pengertian larutan non elektrolit adalah larutan yang tidak dapat menghantarkan arus listrik. Larutan non elektrolit tidak dapat menghantarkan arus listrik karena senyawa nonelektrolit tidak dapat terionisasi sehingga ion-ion penyusunnya tidak dapat bergerak bebas. Contoh larutan nonelektrolit: Urea, glukosa, sukrosa, benzena, dan CCl 4.

Larutan Elektrolit dan Nonelektrolit
Jumlah partikel larutan elektrolit lebih banyak daripada larutan non-elektrolit sehingga sifat koligatifnya pun akan lebih besar. Nilai dari sifat koligatif larutan non-elektrolit dapat diketahui dengan rumus-rumus berikut ini: Penurunan tekanan uap. ΔP = P⁰.
Larutan elektrolit & Non Elektrolit
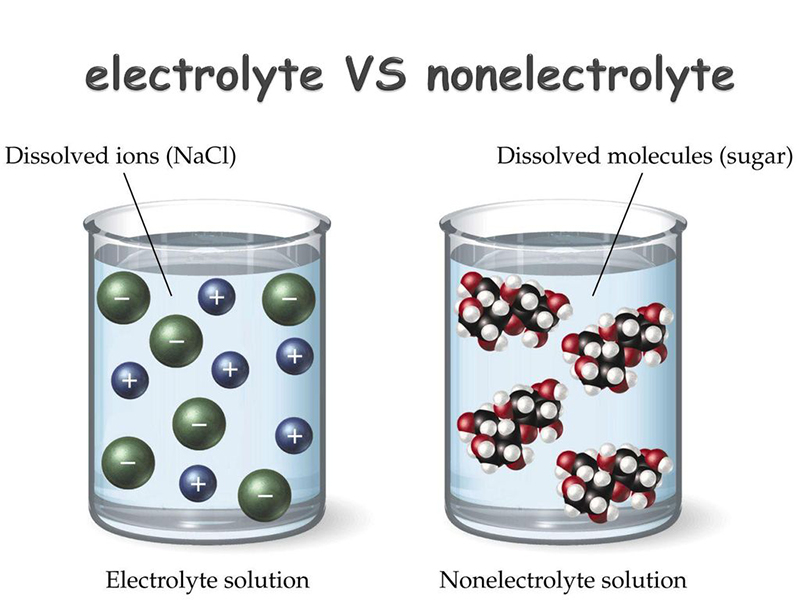
Penjelasan Lengkap: bagaimana cara membedakan larutan elektrolit dan non elektrolit. 1. Elektrolit adalah larutan yang mengandung ion yang dapat menghasilkan arus listrik ketika dilepaskan ke dalam air. 2. Larutan non elektrolit tidak mengandung ion dan tidak dapat menghantarkan arus listrik. 3.

Larutan Elektrolit dan Non Elektrolit, Ini Contoh dan Perbedaannya!
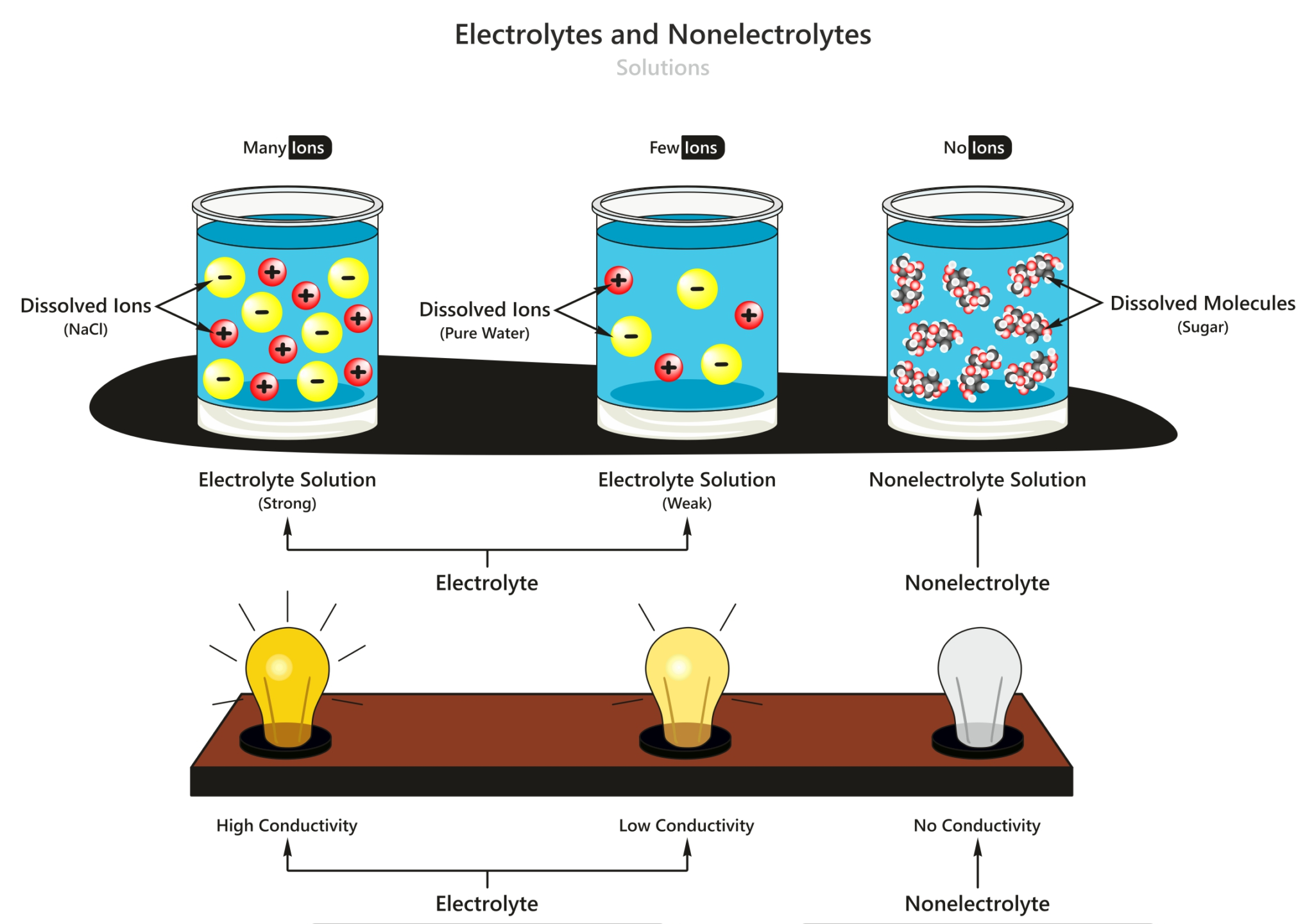
Gambar di atas merupakan salah satu contoh penggambaran perbedaan jumlah molekul ion yang dimiliki oleh elektrolit kuat, elektrolit lemah dan non elektrolit. Di mana larutan non elektrolit tidak menghasilkan ion-ion yang bergerak bebas sehingga tidak akan menghantarkan listrik, sedangkan pada larutan elektrolit kuat maupun lemah memiliki ion.
Larutan Elektrolit dan Non Elektrolit Materi Kimia Kelas 10
Larutan elektrolit mengandung zat-zat yang dapat menghantarkan arus listrik, sedangkan larutan non elektrolit tidak dapat menghantarkan arus listrik. Penting untuk memahami perbedaan antara keduanya, terutama dalam konteks penggunaan dalam industri, kesehatan, dan kimia. Dengan memahami sifat dan karakteristik larutan elektrolit dan non.

contoh soal larutan elektrolit dan non elektrolit Elektrolit larutan perbedaan pengertian hubungan
Artinya, larutan non elektrolit tidak mengandung ion-ion (kation atau anion) yang dapat menghantarkan muatan listrik. Dilansir dari Chemistry LibreTexts, hal tersebut karena zat non elektrolit tidak berdisosiasi sama sekali dan rumus kimia zat tersebut tidak berubah selama proses pelarutan. Zat elektrolit cenderung memiliki ikatan kovalen yang.
Contoh Larutan Elektrolit Dan Non Elektrolit Lengkap Berbagai Contoh
Konsep larutan elektrolit dan non-elektrolit pertama kali dijelaskan oleh ahli kimia asal Swedia, Svante August Arrhenius, pada tahun 1884. Menurut Arrhenius yang dikutip dari Kimia Dasar II oleh Elvy Rahmi Mawarnis, senyawa elektrolit dalam air akan terurai menjadi partikel-partikel yang berupa atom atau gugus atom bermuatan listrik yang.

Mengenal Larutan Elektrolit dan Non Elektrolit Kimia Kelas 10
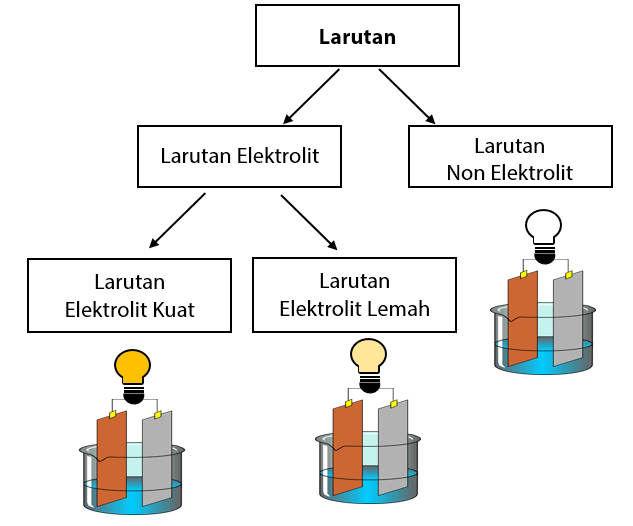
Larutan elektrolit dan non elektrolit memiliki karakteristik sifat yang berbeda. Perbedaannya adalah sebagai berikut: Sifat larutan elektrolit: Dapat menghantarkan listrik. Memiliki derajat ionisasi yang berkisar antara 0 < α ≤ 1. Jika dinyalakan uji daya hantar listrik: gelembung gas yang dihasilkan banyak, lampu menyala.

30 Contoh Larutan Elektrolit dan Non Elektrolit
Singkatnya, berikut perbedaan antara larutan elektrolit dan non elektrolit: 1. Kemampuan menghantarkan listrik. Larutan elektrolit mampu menghantarkan listrik baik itu kuat maupun lemah atau mudahnya larutan elektrolit berperan sebagai konduktor. Sedangkan larutan non elektrolit tidak dapat menghantarkan listrik atau dapat disebut sebagai isolator.

Materi Kimia Elektrolit dan Non Elektrolit YouTube
Perbedaan utama antara larutan elektrolit dengan non elektrolit ialah terletak pada kemampuan menghantar listriknya. Namun, terdapat perbedaan larutan elektrolit dan non elektrolit yang lain, yaitu: Larutan elektrolit mempunyai derajat ionisasi antara 0 hingga 1, sedangkan derajat ionisasi larutan non elektrolit tidak ada atau 0.

Larutan Elektrolit dan Non Elektrolit (Komponen Larutan)
Pengertian Larutan Elektrolit dan Non Elektrolit. Larutan elektrolit adalah larutan yang dapat menghantarkan listrik,. Perbedaan utama larutan elektrolit kuat dan elektrolit lemah adalah daya hantarnya ketika konsentrasi kedua jenis elektrolit sama. Pada elektrolit kuat, elektrolit dapat terurai sempurna atau hampir sempurna menjadi ion-ion.
Larutan Elektrolit dan Nonelektrolit Berita Bisnis dan Wisata Terkini
Larutan elektrolit tinggi memiliki derajat ionisasi (α) yang mendekati 1, berarti zat terlarut hampi semuanya terionisasi. Adapun larutan elektrolit lemah memiliki derajat ionisasi jauh dibawah 1, berarti zat terlarut yang berubah menjadi ion hanya sedikit. Hal ini menyebabkan larutan elektrolit lemah menghantarkan listrik dengan kurang baik.

Contoh Senyawa Elektrolit Dan Non Elektrolit Gelinding Maju
Perbedaan Larutan Elektrolit dan Larutan Non Elektrolit. Larutan elektrolit dan larutan non elektrolit mempunyai karakteristik atau sifat yang berbeda. Berikut ini adalah perbedaannya; Sifat dari larutan elektrolit; Bisa menghantarkan listrik. Mempunyai derajat ionisasi yang berkisar antara 0 < α ≤ 1. Apabila dilakukan uji daya hantar.
Larutan Elektrolit dan Non Elektrolit
Beberapa ciri kimia dan fisik yang harus diperhatikan adalah: 1) konduktivitas listrik, 2) kelarutan, 3) kekentalan, 4) titik didih, 5) titik lebur, dan 6) pH. Pertama, konduktivitas listrik merupakan karakteristik yang paling penting untuk membedakan larutan elektrolit dan non elektrolit.